
เนื้อหา iLive ทั้งหมดได้รับการตรวจสอบทางการแพทย์หรือตรวจสอบข้อเท็จจริงเพื่อให้แน่ใจว่ามีความถูกต้องตามจริงมากที่สุดเท่าที่จะเป็นไปได้
เรามีแนวทางการจัดหาที่เข้มงวดและมีการเชื่อมโยงไปยังเว็บไซต์สื่อที่มีชื่อเสียงสถาบันการวิจัยทางวิชาการและเมื่อใดก็ตามที่เป็นไปได้ โปรดทราบว่าตัวเลขในวงเล็บ ([1], [2], ฯลฯ ) เป็นลิงก์ที่คลิกได้เพื่อการศึกษาเหล่านี้
หากคุณรู้สึกว่าเนื้อหาใด ๆ ของเราไม่ถูกต้องล้าสมัยหรือมีข้อสงสัยอื่น ๆ โปรดเลือกแล้วกด Ctrl + Enter
ไวรัสเอชไอวี (HIV)
ผู้เชี่ยวชาญทางการแพทย์ของบทความ
ตรวจสอบล่าสุด: 04.07.2025
โรคภูมิคุ้มกันบกพร่องได้รับการระบุว่าเป็นโรคเฉพาะในปี 1981 ในสหรัฐอเมริกา เมื่อคนหนุ่มสาวจำนวนมากเกิดอาการป่วยร้ายแรงที่เกิดจากจุลินทรีย์ที่ไม่ก่อโรคหรือก่อโรคได้เล็กน้อยในคนที่มีสุขภาพดี การศึกษาสถานะภูมิคุ้มกันของผู้ป่วยเผยให้เห็นว่าจำนวนลิมโฟไซต์โดยทั่วไปและโดยเฉพาะอย่างยิ่ง T-helper ลดลงอย่างรวดเร็ว โรคนี้เรียกว่า AIDS (Acquired Immune Deficiency Syndrome) วิธีการติดเชื้อ (การสัมผัสทางเพศ ผ่านเลือดและการเตรียมเลือด) บ่งบอกถึงลักษณะการติดเชื้อของโรค
เชื้อก่อโรคเอดส์ถูกค้นพบในปี พ.ศ. 2526 โดยชาวฝรั่งเศสชื่อ L. Montagnier โดยเรียกเชื้อนี้ว่า LAV Lymphoadenopathy Associated Virus เนื่องจากเขาพบเชื้อนี้ในผู้ป่วยที่มีต่อมน้ำเหลืองโต และ R. Gallo ชาวอเมริกันเรียกไวรัสนี้ว่า HTLV-III (Human T-lymphotropic Virus III) ก่อนหน้านี้เขาเคยค้นพบไวรัส lymphotropic I และ II มาแล้ว
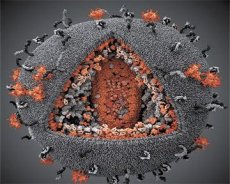
การเปรียบเทียบคุณสมบัติของไวรัส LAV และ HTLV-III แสดงให้เห็นถึงเอกลักษณ์ของไวรัส ดังนั้นเพื่อหลีกเลี่ยงความสับสน ไวรัสจึงถูกตั้งชื่อว่า HIV (Human Immunodeficiency Virus หรือ HIV) ในปี 1986 HIV มีรูปร่างเป็นทรงกลม โดยมีเส้นผ่านศูนย์กลาง 110 นาโนเมตร เยื่อหุ้มไวรัสมีรูปร่างเป็นทรงหลายเหลี่ยม ประกอบด้วยรูปห้าเหลี่ยม 12 รูปและรูปหกเหลี่ยม 20 รูป ตรงกลางและมุมของรูปหกเหลี่ยมแต่ละรูปมีโมเลกุลของโปรตีน gpl20 ที่ถูกไกลโคซิเลต (เลข 120 หมายถึงน้ำหนักโมเลกุลของโปรตีนในหน่วยกิโลดาลตัน) มีโมเลกุล gpl20 ทั้งหมด 72 โมเลกุลอยู่บนพื้นผิวของไวรัสในรูปของหนามแหลมที่แปลกประหลาด ซึ่งแต่ละหนามแหลมจะเกี่ยวข้องกับโปรตีนภายในเยื่อหุ้มเซลล์ gp41 โปรตีนเหล่านี้ร่วมกับชั้นลิพิดคู่จะสร้างเป็นซูเปอร์แคปซิด (เยื่อหุ้มเซลล์) ของไวรัส
โปรตีน gpl20 และ gp41 ก่อตัวขึ้นโดยการตัดโปรตีนพรีเคอร์เซอร์ของ Env ด้วยโปรตีเอสของเซลล์ โปรตีน gp41 ก่อตัวเป็น "สเต็ม" ของสไปค์โดยการจับกับโดเมนไซโทพลาสมิกของมันกับโปรตีนเมทริกซ์ p17MA ซึ่งอยู่ใต้เยื่อหุ้มเซลล์โดยตรง โมเลกุล p17 จะโต้ตอบกันระหว่างการเจริญเติบโตของไวรัสเพื่อสร้างรูปทรงยี่สิบหน้าซึ่งอยู่ใต้เยื่อหุ้มเซลล์
ในส่วนกลางของไวรัส โปรตีน p24 จะสร้างแคปซิดที่มีรูปร่างเหมือนกรวย ส่วนที่แคบของแคปซิดจะเชื่อมต่อกับเยื่อหุ้มไวรัสโดยมีโปรตีน rb เข้ามาเกี่ยวข้อง ภายในแคปซิดจะมีโมเลกุล RNA ของไวรัสที่เหมือนกัน 2 โมเลกุล ซึ่งเชื่อมต่อกันด้วยปลาย 5' กับโปรตีนนิวคลีโอแคปซิด p7NC โปรตีนนี้มีความน่าสนใจเนื่องจากมีกรดอะมิโน 2 ตัว (โมทิฟ) ที่อุดมไปด้วยซิสเตอีนและฮีสติดีน และมีอะตอมสังกะสีอยู่ด้วย เรียกว่า "ซิงค์ฟิงเกอร์" เนื่องจากจับโมเลกุลของ RNA ของไวรัสเพื่อรวมเข้าในไวรัสที่กำลังก่อตัว แคปซิดยังมีเอนไซม์ 3 ชนิดอีกด้วย รีเวอร์เทส (RT) หรือคอมเพล็กซ์โพลประกอบด้วยรีเวิร์สทรานสคริปเทส RNase H และดีเอ็นเอโพลีเมอเรสที่ขึ้นกับดีเอ็นเอ รีเวอร์เทสมีอยู่ในรูปเฮเทอโรไดเมอร์ p66/p51 โปรตีเอส (PR) - p10 เริ่มต้นและดำเนินการกระบวนการทำให้ไวรัสสุก อินเทเกรส (IN) - p31 หรือเอนโดนิวคลีเอส ช่วยให้มีการรวมดีเอ็นเอของโปรไวรัสเข้าไปในจีโนมของเซลล์โฮสต์ แคปซิดยังประกอบด้วยโมเลกุลของไพรเมอร์อาร์เอ็นเอ (tRNAl"3) อีกด้วย
จีโนม RNA ในเซลล์จะถูกแปลงเป็นจีโนม DNA (DNA provirus) ด้วยความช่วยเหลือของ reverse transcriptase ซึ่งประกอบด้วยคู่ของนิวคลีโอไทด์ 9,283 คู่ โดยถูกจำกัดไว้ทางด้านซ้ายและขวาด้วยสิ่งที่เรียกว่า long terminal repeats หรือ LTR ได้แก่ S'-LTR ทางซ้ายและ 3'-LTR ทางขวา โดย LTR แต่ละอันประกอบด้วยคู่ของนิวคลีโอไทด์ 638 คู่
จีโนมของ HIV ประกอบด้วยยีน 9 ตัว โดยบางยีนทับซ้อนกันที่ปลายทั้งสองข้าง (มีกรอบการอ่านหลายกรอบ) และมีโครงสร้างเอ็กโซนินทรอน ยีนเหล่านี้ควบคุมการสังเคราะห์โปรตีนโครงสร้าง 9 ตัวและโปรตีนควบคุม 6 ตัว
ความสำคัญของ LTR สำหรับจีโนมของไวรัสก็คือมีองค์ประกอบควบคุมต่อไปนี้ซึ่งควบคุมการทำงานของไวรัส:
- สัญญาณการถอดรหัส (บริเวณโปรโมเตอร์)
- สัญญาณการบวกโพลี-เอ
- สัญญาณการปิดฝา
- สัญญาณการบูรณาการ;
- สัญญาณการควบคุมเชิงบวก (TAR สำหรับโปรตีน TAT)
- องค์ประกอบควบคุมเชิงลบ (NRE สำหรับโปรตีน NEF)
- ไซต์สำหรับยึดไพรเมอร์ RNA (tRNA™3) สำหรับการสังเคราะห์ DNA สายเล็กที่ปลาย 3' สัญญาณที่ปลาย 5' ของ LTR ซึ่งทำหน้าที่เป็นไพรเมอร์สำหรับการสังเคราะห์ DNA สายเล็ก
นอกจากนี้ LTR ยังมีองค์ประกอบที่เกี่ยวข้องกับการควบคุมการต่อกันของ mRNA การบรรจุโมเลกุล vRNA ลงในแคปซิด (องค์ประกอบ Psi) ในที่สุด ในระหว่างการถอดรหัสจีโนม สัญญาณสองสัญญาณจะถูกสร้างขึ้นใน mRNA ยาวสำหรับโปรตีน REV ซึ่งสลับการสังเคราะห์โปรตีน: CAR - สำหรับโปรตีนควบคุม และ CRS - สำหรับโปรตีนโครงสร้าง หากโปรตีน REV จับกับ CAR โปรตีนโครงสร้างจะถูกสังเคราะห์ หากไม่มีโปรตีนควบคุม ก็จะมีการสังเคราะห์เฉพาะโปรตีนควบคุมเท่านั้น
ยีนควบคุมต่อไปนี้และโปรตีนมีบทบาทสำคัญอย่างยิ่งในการควบคุมการทำงานของจีโนมไวรัส:
- โปรตีน TAT ซึ่งทำหน้าที่ควบคุมการจำลองของไวรัสในเชิงบวกและทำหน้าที่ผ่านบริเวณควบคุม TAR
- โปรตีน NEV และ VPU ซึ่งควบคุมการจำลองแบบเชิงลบผ่านบริเวณ NRE
- โปรตีน REV ซึ่งควบคุมเชิงบวกและเชิงลบ โปรตีน REV ควบคุมการทำงานของยีน gag, pol, env และควบคุมการตัดต่อในเชิงลบ
ดังนั้นการจำลองแบบของ HIV จึงอยู่ภายใต้การควบคุมสามประการ ได้แก่ บวก ลบ และบวก-ลบ
โปรตีน VIF เป็นตัวกำหนดความสามารถในการติดเชื้อของไวรัสที่เพิ่งสังเคราะห์ขึ้นใหม่ โดยโปรตีน VIF จะเกี่ยวข้องกับโปรตีนแคปซิด p24 และพบในไวรัสจำนวน 60 โมเลกุล โปรตีน NEF จะแสดงอยู่ในไวรัสโดยโมเลกุลจำนวนเล็กน้อย (5-10 โมเลกุล) ซึ่งอาจเกี่ยวข้องกับเยื่อหุ้มเซลล์
โปรตีน VPR ยับยั้งวงจรของเซลล์ในระยะ G2 มีส่วนร่วมในการเคลื่อนย้ายของคอมเพล็กซ์พรีอินทิเกรชันเข้าไปในนิวเคลียสของเซลล์ กระตุ้นยีนไวรัสและเซลล์บางชนิด และเพิ่มประสิทธิภาพในการจำลองไวรัสในโมโนไซต์และแมคโครฟาจ ตำแหน่งของโปรตีน VPR, TAT, REV และ VPU ในไวรัสยังไม่ได้รับการยืนยัน
นอกจากโปรตีนของตัวเองแล้ว เยื่อหุ้มไวรัสยังอาจมีโปรตีนของเซลล์โฮสต์อยู่ด้วย โปรตีน VPU และ VPR มีส่วนร่วมในการควบคุมการสืบพันธุ์ของไวรัส
แอนติเจนของไวรัสเอชไอวี (HIV)
ไวรัสเอชไอวี (HIV) มีความแปรปรวนมาก แม้แต่จากร่างกายของผู้ป่วยเพียงคนเดียว ก็สามารถแยกสายพันธุ์ไวรัสที่มีคุณสมบัติแอนติเจนต่างกันอย่างมากได้ ความแปรปรวนดังกล่าวเกิดขึ้นจากการทำลายเซลล์ CD4+ อย่างเข้มข้นและการตอบสนองของแอนติบอดีที่มีประสิทธิภาพต่อการติดเชื้อเอชไอวี HIV-2 รูปแบบใหม่ซึ่งใกล้เคียงกับ HIV-1 ทางชีวภาพแต่มีความแตกต่างทางภูมิคุ้มกันจาก HIV-1 ได้รับการแยกจากผู้ป่วยในแอฟริกาตะวันตก ความคล้ายคลึงกันของโครงสร้างหลักของจีโนมของไวรัสเหล่านี้คือ 42% โปรไวรัส DNA HIV-2 ประกอบด้วย 9,671 bp และ LTR - 854 bp ต่อมามีการแยก HIV-2 ในภูมิภาคอื่นๆ ของโลก ไม่มีภูมิคุ้มกันข้ามกันระหว่าง HIV-1 และ HIV-2 HIV-1 มีอยู่ 2 รูปแบบใหญ่ที่ทราบกันดี ได้แก่ O (Outlier) และ M (Major) โดยหลังแบ่งออกเป็น 10 ชนิดย่อย (AJ) มีแปดชนิดย่อย (AH) หมุนเวียนอยู่ในรัสเซีย
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
กลไกการโต้ตอบระหว่างเชื้อ HIV กับเซลล์
เมื่อเข้าสู่ร่างกายแล้ว ไวรัสจะโจมตีเซลล์ที่มีตัวรับ CD4 เฉพาะของร่างกายก่อน ตัวรับนี้พบมากใน T-helper และพบน้อยในแมคโครฟาจและโมโนไซต์ โดย T-helper จะไวต่อไวรัสเป็นพิเศษ
ไวรัสเอชไอวี (HIV) จดจำตัวรับ CD4 โดยใช้โปรตีน gpl20 กระบวนการโต้ตอบระหว่างไวรัสเอชไอวีกับเซลล์เกิดขึ้นตามรูปแบบต่อไปนี้: การดูดซับที่ตัวรับเป็นตัวกลาง -> หลุมเคลือบ -> ถุงเคลือบ -> ไลโซโซม ในนั้น เยื่อหุ้มไวรัสจะหลอมรวมกับเยื่อหุ้มไลโซโซม และนิวคลีโอแคปซิดที่แยกออกจากซูเปอร์แคปซิดจะเข้าสู่ไซโทพลาซึม ระหว่างทางไปยังนิวเคลียส นิวคลีโอแคปซิดจะถูกทำลาย และอาร์เอ็นเอจีโนมและส่วนประกอบหลักที่เกี่ยวข้องจะถูกปลดปล่อย จากนั้น ทรานสคริปเทสย้อนกลับจะสังเคราะห์สายลบของดีเอ็นเอบนอาร์เอ็นเอของไวรัส จากนั้น RNase H จะทำลายอาร์เอ็นเอของไวรัส และดีเอ็นเอโพลีเมอเรสของไวรัสจะสังเคราะห์สายบวกของดีเอ็นเอ 5'-LTR และ 3'-LTR จะถูกสร้างขึ้นที่ปลายของโปรไวรัสดีเอ็นเอ โปรไวรัส DNA สามารถคงอยู่ในนิวเคลียสได้ระยะหนึ่งในรูปแบบที่ไม่ทำงาน แต่ไม่ช้าก็เร็ว โปรไวรัสจะรวมเข้ากับโครโมโซมของเซลล์เป้าหมายด้วยความช่วยเหลือของอินทิเกรส ในโปรไวรัส DNA โปรไวรัสจะยังคงไม่ทำงานจนกว่าทีลิมโฟไซต์ที่กำหนดจะถูกกระตุ้นโดยแอนติเจนของจุลินทรีย์หรือเซลล์ภูมิคุ้มกันอื่นๆ การกระตุ้นการถอดรหัสดีเอ็นเอของเซลล์ถูกควบคุมโดยปัจจัยนิวเคลียร์พิเศษ (NF-kB) โปรไวรัส DNA เป็นโปรตีนที่จับกับดีเอ็นเอและถูกผลิตในปริมาณมากในระหว่างการกระตุ้นและการแพร่กระจายของทีลิมโฟไซต์และโมโนไซต์ โปรตีนนี้จะจับกับลำดับดีเอ็นเอของเซลล์และลำดับ LTR ที่คล้ายกันของโปรไวรัส DNA และกระตุ้นการถอดรหัสดีเอ็นเอของเซลล์และโปรไวรัส DNA ด้วยการเหนี่ยวนำการถอดรหัสของโปรไวรัส DNA โปรไวรัสจะเปลี่ยนสถานะของไวรัสจากสถานะที่ไม่ทำงานไปเป็นสถานะที่ทำงาน และจากการติดเชื้อที่ต่อเนื่องไปเป็นการติดเชื้อที่มีประสิทธิผล โปรไวรัสสามารถคงอยู่ในสถานะที่ไม่ทำงานเป็นเวลานานมาก การทำงานของไวรัสถือเป็นช่วงเวลาสำคัญในการโต้ตอบกับเซลล์
ตั้งแต่ช่วงเวลาที่ไวรัสเข้าสู่เซลล์ ระยะเวลาของการติดเชื้อ HIVก็เริ่มขึ้น - สถานะพาหะของไวรัสซึ่งอาจกินเวลานานถึง 10 ปีหรือมากกว่านั้น และตั้งแต่ช่วงเวลาที่ไวรัสถูกกระตุ้น โรคก็เริ่มขึ้น - เอดส์ ด้วยความช่วยเหลือของยีนควบคุมและผลิตภัณฑ์ของยีน ไวรัสจะเริ่มขยายพันธุ์อย่างแข็งขัน โปรตีน TAT สามารถเพิ่มอัตราการขยายพันธุ์ของไวรัสได้ถึง 1,000 เท่า การถอดรหัสของไวรัสมีความซับซ้อน ซึ่งรวมถึงการสร้าง mRNA ทั้งแบบเต็มความยาวและย่อยจีโนม การต่อกันของ mRNA จากนั้นจึงเกิดการสังเคราะห์โปรตีนโครงสร้างและควบคุม
การสังเคราะห์โปรตีนโครงสร้างเกิดขึ้นดังนี้ ขั้นแรก โปรตีนโพลีโปรตีนพรีเคอร์เซอร์ Pr55Gag (โปรตีนที่มีน้ำหนักโมเลกุล 55 kDa) จะถูกสังเคราะห์ โปรตีนนี้ประกอบด้วยโดเมนหลัก 4 โดเมน ได้แก่ เมทริกซ์ (MA) แคปซิด (CA) นิวคลีโอแคปซิด (NC) และโดเมน rb ซึ่งโปรตีนโครงสร้าง p17, p24, p7 และ rb จะถูกสร้างขึ้นตามลำดับจากการตัด Pr55Gag โดยโปรตีเอสของไวรัส (ซึ่งตัดเองจากโปรตีนพรีเคอร์เซอร์ตัวอื่น Gag-Pol) การก่อตัวของโปรตีนโพลีโปรตีน Pr55Gag เป็นเงื่อนไขหลักสำหรับการก่อตัวของอนุภาคไวรัส โปรตีนนี้เองที่เป็นตัวกำหนดโปรแกรมการสร้างรูปร่างของไวรัส โดยจะรวมถึงขั้นตอนการขนส่งของโปรตีนโพลีโปรตีน Gag ไปยังเยื่อหุ้มพลาสมา การโต้ตอบกับโปรตีนโพลีโปรตีน และปฏิสัมพันธ์ระหว่างโปรตีนระหว่างการก่อตัวของอนุภาคไวรัสและการแตกหน่อตามลำดับ Pr55Gag ถูกสังเคราะห์บนโพลีไรโบโซมอิสระ โมเลกุลโปรตีนจะถูกส่งไปยังเยื่อหุ้มเซลล์ ซึ่งโมเลกุลโปรตีนจะถูกยึดไว้โดยบริเวณที่ไม่ชอบน้ำ โดเมน CA มีบทบาทสำคัญในการสร้างโครงสร้างดั้งเดิมของโปรตีน Gag โดเมน NC ช่วยให้มีการรวมโมเลกุล RNA จีโนม 2 โมเลกุลในองค์ประกอบของอนุภาคไวรัสที่กำลังก่อตัว (ด้วยความช่วยเหลือของ "นิ้วสังกะสี") โมเลกุลโพลีโปรตีนจะเกิดไดเมอร์ในขั้นต้นเนื่องจากปฏิสัมพันธ์ระหว่างโดเมนเมทริกซ์ จากนั้นไดเมอร์จะรวมกันเป็นคอมเพล็กซ์เฮกซะเมอร์ (6 หน่วย) อันเป็นผลจากปฏิสัมพันธ์ระหว่างโดเมน CA และ NC ในที่สุด เฮกซะเมอร์ที่รวมตัวกันที่พื้นผิวด้านข้างจะสร้างไวรัสทรงกลมที่ยังไม่โตเต็มที่ ซึ่งมี RNA จีโนมของไวรัสอยู่ภายใน โดยถูกจับโดยโดเมน NC
โปรตีนพรีเคอร์เซอร์อีกชนิดหนึ่งคือ Prl60Gag-Pol (โปรตีนที่มีน้ำหนักโมเลกุล 160 kDa) ซึ่งสังเคราะห์ขึ้นจากการเลื่อนเฟรมของไรโบโซมระหว่างการแปลปลาย 3' ของยีน gag ในบริเวณที่อยู่ต้นน้ำของบริเวณที่เข้ารหัสโปรตีน rb ทันที โพลีโปรตีน Gag-Pol นี้ประกอบด้วยลำดับโปรตีน Gag ที่ไม่สมบูรณ์ (กรดอะมิโน 1-423) และลำดับ Pol ที่รวมถึงโดเมน PR, RT และ IN โมเลกุลโพลีโปรตีน Gag-Pol ยังสังเคราะห์ขึ้นบนโพลีไรโบโซมอิสระและถูกขนส่งไปยังเยื่อหุ้มพลาสมา โพลีโปรตีน Prl60Gagpol ประกอบด้วยไซต์ปฏิสัมพันธ์ระหว่างโมเลกุลทั้งหมดและไซต์การจับกับเยื่อหุ้มเซลล์ที่มีอยู่ในโพลีโปรตีน Gag ดังนั้น โมเลกุลโพลีโปรตีน Gag-Pol จึงหลอมรวมกับเยื่อหุ้มเซลล์ และรวมเข้ากับไวรัสที่กำลังก่อตัวพร้อมกับโมเลกุล Gag ส่งผลให้เกิดโปรตีเอสที่ทำงานอยู่และกระบวนการทำให้ไวรัสสุกเริ่มต้นขึ้น โปรตีเอสของ HIV-1 จะทำงานได้สูงเฉพาะในรูปของไดเมอร์เท่านั้น ดังนั้น โปรตีเอสของ HIV-1 จึงจำเป็นต้องสร้างไดเมอร์ของโมเลกุลเหล่านี้เพื่อตัดออกจาก Prl60Gag-Pol การทำให้ไวรัสสุกประกอบด้วยข้อเท็จจริงที่ว่าโปรตีเอสที่ทำงานอยู่ซึ่งถูกปลดปล่อยออกมาจะตัด prl60Gag-Pol และ Gag55 ในตำแหน่งที่มันรู้จัก โปรตีน p17, p24, p7, p6, revertase, integrase จะถูกสร้างขึ้น และโปรตีนเหล่านี้ก็จะรวมตัวกันในโครงสร้างของไวรัส
โปรตีน Env สังเคราะห์ขึ้นบนไรโบโซมที่เชื่อมโยงกับเยื่อหุ้มเซลล์ของเอนโดพลาสมิก เรติคูลัม จากนั้นจึงถูกไกลโคซิเลต ตัดด้วยโปรตีเอสของเซลล์เป็น gp120 และ gp41 แล้วส่งไปที่พื้นผิวเซลล์ ในกรณีนี้ gp41 จะแทรกซึมผ่านเยื่อหุ้มเซลล์และจับกับโดเมนเมทริกซ์ของโมเลกุลโปรตีน Gag ที่เชื่อมโยงกับพื้นผิวด้านในของเยื่อหุ้มเซลล์ การเชื่อมต่อนี้จะถูกเก็บรักษาไว้ในไวรัสที่โตเต็มที่
ดังนั้นการประกอบกันของอนุภาคไวรัสจึงประกอบด้วยการรวมตัวของโปรตีนเบื้องต้นและโมเลกุล RNA ที่เกี่ยวข้องบนเยื่อหุ้มพลาสมาของเซลล์โฮสต์ การก่อตัวของไวรัสที่ยังไม่โตเต็มที่ และการปลดปล่อยไวรัสเหล่านี้โดยการแตกหน่อจากพื้นผิวเซลล์ ในระหว่างการแตกหน่อ ไวรัสจะหุ้มตัวเองด้วยเยื่อหุ้มเซลล์ซึ่งโมเลกุล gp41 และ gp120 ฝังอยู่ ในระหว่างการแตกหน่อหรืออาจเป็นไปได้หลังจากการปล่อยไวรัสออกไป ไวรัสจะเติบโตเต็มที่ ซึ่งดำเนินการด้วยความช่วยเหลือของโปรตีเอสของไวรัสและประกอบด้วยการตัดโปรตีนเบื้องต้น Pr55Gag และ Prl60Gag-Pol ด้วยโปรตีเอสเป็นโปรตีนของไวรัสที่โตเต็มที่และการรวมตัวเป็นคอมเพล็กซ์โครงสร้างบางส่วน บทบาทหลักในกระบวนการสร้างรูปร่างของไวรัสคือโพลีโปรตีนเบื้องต้น Pr55Gag ซึ่งจัดระเบียบและประกอบไวรัสที่ยังไม่โตเต็มที่ กระบวนการเติบโตเต็มที่ของไวรัสจะเสร็จสมบูรณ์โดยโปรตีเอสของไวรัสเฉพาะ
สาเหตุของภาวะภูมิคุ้มกันบกพร่อง
สาเหตุหลักประการหนึ่งของภาวะภูมิคุ้มกันบกพร่องในผู้ติดเชื้อเอชไอวีคือการเสียชีวิตจำนวนมากของ T-helper ซึ่งเกิดจากเหตุการณ์ดังต่อไปนี้ ประการแรก T-helper ที่ติดเชื้อไวรัสจะเสียชีวิตเนื่องจากอะพอพโทซิส เชื่อกันว่าในผู้ป่วยเอดส์ การจำลองไวรัส อะพอพโทซิส และการลดลงของจำนวน T-helper เชื่อมโยงกัน ประการที่สอง T-killer จะจดจำและทำลาย T-cells ที่ติดเชื้อไวรัสหรือมีโมเลกุล gpl20 ที่ดูดซับไว้ รวมถึง T-helper ที่ติดเชื้อไวรัสและไม่ติดเชื้อไวรัส ซึ่งก่อตัวเป็นซิมพลาสต์ (ซิงซิเทียม) ที่ประกอบด้วยเซลล์หลายสิบเซลล์ (บางส่วนตายเนื่องจากไวรัสแพร่พันธุ์ในเซลล์เหล่านั้น) ผลจากการทำลาย T-helpers จำนวนมาก ทำให้การแสดงออกของตัวรับเยื่อหุ้มเซลล์ใน B-lymphocytes เป็น interleukin-2 ลดลง การสังเคราะห์ interleukin ต่างๆ (ปัจจัยการเจริญเติบโตและการแบ่งตัวของ B-lymphocytes - IL-4, IL-5, IL-6 เป็นต้น) ถูกขัดขวาง ส่งผลให้การทำงานของระบบ T-killer ถูกขัดขวาง การทำงานของระบบคอมพลีเมนต์และแมคโครฟาจถูกระงับ แมคโครฟาจและโมโนไซต์ที่ติดเชื้อไวรัสจะไม่ตายเป็นเวลานาน แต่ไม่สามารถกำจัดไวรัสออกจากร่างกายได้ ในที่สุด เนื่องจากโครงสร้างและแอนติเจนที่คล้ายคลึงกันของ gpl20 กับตัวรับของเซลล์เยื่อบุผิวบางชนิดของร่างกาย (รวมถึงตัวรับ trophoblast ที่ทำหน้าที่เป็นตัวกลางในการถ่ายทอด HIV จากการปลูกถ่าย) จึงมีการสังเคราะห์แอนติบอดีต่อตัวรับที่มีสเปกตรัมการทำงานกว้าง แอนติบอดีดังกล่าวสามารถปิดกั้นตัวรับเซลล์ต่างๆ และทำให้โรคดำเนินไปอย่างซับซ้อนด้วยโรคภูมิต้านทานตนเอง ผลที่ตามมาของการติดเชื้อ HIV คือความพ่ายแพ้ของระบบภูมิคุ้มกันหลักทั้งหมด ผู้ป่วยดังกล่าวจะไม่สามารถป้องกันตัวเองจากจุลินทรีย์หลากหลายชนิดได้ ซึ่งนำไปสู่การติดเชื้อฉวยโอกาสและเนื้องอก สำหรับผู้ป่วยที่ติดเชื้อ HIV ความเสี่ยงในการเกิดมะเร็งอย่างน้อยสามชนิดจะเพิ่มขึ้น: ซาร์โคมาของ Kaposi; มะเร็งผิวหนัง (รวมถึงมะเร็งผิวหนัง) และมะเร็งต่อมน้ำเหลืองชนิด B ซึ่งเกิดจากการเปลี่ยนแปลงของ B-lymphocytes อย่างไรก็ตาม HIV ไม่เพียงแต่จะกระตุ้นเซลล์เม็ดเลือดขาวเท่านั้น แต่ยังกระตุ้นระบบประสาทอีกด้วย โดยจะแทรกซึมเข้าสู่เซลล์ของระบบประสาทส่วนกลาง (astrocytes) ทั้งโดยการรับเข้าทางตัวรับและการจับกินลิมโฟบลาสต์ที่ติดเชื้อไวรัสโดย astrocytes เมื่อไวรัสโต้ตอบกับ astrocytes ก็จะเกิดการสร้างซิมพลาสต์ด้วย ซึ่งช่วยให้เชื้อโรคแพร่กระจายผ่านช่องทางระหว่างเซลล์ได้ง่ายขึ้น ไวรัสสามารถคงอยู่ในแมคโครฟาจและโมโนไซต์ได้เป็นเวลานาน จึงทำหน้าที่เป็นแหล่งกักเก็บและกระจายไวรัสในร่างกาย โดยสามารถแทรกซึมเข้าไปในเนื้อเยื่อทั้งหมดได้ แมคโครฟาจที่ติดเชื้อมีบทบาทสำคัญในการนำ HIV เข้าสู่ระบบประสาทส่วนกลางและก่อให้เกิดความเสียหาย ในผู้ป่วย 10% อาการทางคลินิกหลักเกี่ยวข้องกับความเสียหายต่อระบบประสาทส่วนกลางและแสดงอาการเป็นโรคสมองเสื่อม ดังนั้น ผู้ติดเชื้อ HIV จึงมีลักษณะของโรค 3 กลุ่ม ได้แก่ โรคติดเชื้อฉวยโอกาสโรคเนื้องอกและความเสียหายต่อระบบประสาทส่วนกลาง
ระบาดวิทยาของการติดเชื้อเอชไอวี
แหล่งที่มาของการติดเชื้อ HIV อยู่ที่ตัวบุคคลเท่านั้น ไม่ว่าจะเป็นผู้ป่วยหรือผู้ที่เป็นพาหะของไวรัส ไวรัสเอชไอวี (HIV) มีอยู่ในเลือด อสุจิ ของเหลวจากปากมดลูก ส่วนในแม่ที่ให้นมบุตรจะอยู่ในน้ำนมแม่ การติดเชื้อเกิดขึ้นทางเพศสัมพันธ์ ผ่านทางเลือดและการเตรียมเลือด ตลอดจนจากแม่สู่ลูกก่อน ระหว่าง และหลังคลอด ยังไม่มีข้อมูลแน่ชัดว่าการติดเชื้อไวรัสผ่านทางอาหาร เครื่องดื่ม และแมลงกัดต่อยนั้นเกิดขึ้นได้อย่างไร
การติดยาเป็นสาเหตุของการแพร่ระบาดของโรคเอดส์ อุบัติการณ์ของการติดเชื้อเอชไอวีเพิ่มขึ้นทุกปี ตามข้อมูลขององค์การอนามัยโลก ตั้งแต่ปี 1980 ถึง 2000 มีผู้ติดเชื้อเอชไอวี 58 ล้านคน เฉพาะในปี 2000 มีผู้ติดเชื้อทั่วโลก 5.3 ล้านคน และมีผู้เสียชีวิตจากโรคเอดส์ 3 ล้านคน ณ วันที่ 1 มกราคม 2004 มีผู้ติดเชื้อเอชไอวี 264,000 คนในรัสเซีย ผู้ติดเชื้อเอชไอวีครึ่งหนึ่งเสียชีวิตภายใน 11-12 ปีนับตั้งแต่ได้รับเชื้อ ในช่วงต้นปี 2004 จากประชากรรัสเซีย 100,000 คน มีประมาณ 180 คนที่ได้รับการวินิจฉัยว่า "ติดเชื้อเอชไอวี" คาดว่าหากอัตราป่วยสูงเช่นนี้ จำนวนผู้ติดเชื้อเอชไอวีในรัสเซียภายในปี 2012 จะอยู่ที่ 2.5-3 ล้านคน ความซับซ้อนของการต่อสู้กับการติดเชื้อเอชไอวีขึ้นอยู่กับหลายสาเหตุ ประการแรก ไม่มีวิธีการรักษาและการป้องกันที่เฉพาะเจาะจง ประการที่สอง ระยะฟักตัวของการติดเชื้อ HIV อาจยาวนานกว่า 10 ปี ขึ้นอยู่กับช่วงเวลาที่เซลล์ทีลิมโฟไซต์และโปรไวรัส DNA ที่อยู่ในโครโมโซมทำงาน ยังไม่ชัดเจนว่าผู้ที่ติดเชื้อไวรัสทุกคนจะต้องติดเอดส์หรือไม่ หรือสามารถแพร่เชื้อโดยไม่ป่วยในระยะยาวได้หรือไม่ (ซึ่งดูไม่น่าจะเป็นไปได้) สุดท้ายนี้ มีไวรัสภูมิคุ้มกันบกพร่องในมนุษย์หลายชนิด (HIV-1, HIV-2) ซึ่งความแตกต่างของแอนติเจนระหว่างไวรัสทั้งสองชนิดจะป้องกันไม่ให้เกิดภูมิคุ้มกันข้ามกันได้ การค้นพบไวรัสภูมิคุ้มกันบกพร่องในลิง (SIV) ทำให้สามารถไขข้อสงสัยเกี่ยวกับต้นกำเนิดของ HIV ได้ SIV มีโครงสร้างจีโนมคล้ายกับ HIV แต่แตกต่างกันอย่างมากในลำดับนิวคลีโอไทด์ HIV-2 อยู่ในตำแหน่งกลางระหว่าง HIV-1 และ SIV ในด้านคุณสมบัติทางเซรุ่มวิทยา และใกล้เคียงกับ SIV ในด้านลำดับนิวคลีโอไทด์มากกว่า ในเรื่องนี้ VM Zhdanov แนะนำว่าไวรัส HIV-1, HIV-2 และ SIV มีต้นกำเนิดมาจากบรรพบุรุษร่วมกัน เป็นไปได้ตามที่ R. Gallo กล่าวไว้ว่า SIV หนึ่งตัวได้เข้าสู่ร่างกายมนุษย์โดยผ่านการกลายพันธุ์หลายครั้ง ส่งผลให้เกิด HIV-1, HIV-2 และรูปแบบอื่นๆ เกิดขึ้น
อาการติดเชื้อ HIV
ไวรัสเอชไอวีในมนุษย์มีคุณสมบัติบางอย่างที่กำหนดการก่อโรคได้เป็นส่วนใหญ่ ไวรัสมีอัตราการขยายพันธุ์ที่สูงมาก ซึ่งกำหนดโดยองค์ประกอบควบคุมของมัน (ไวรัสสังเคราะห์ได้มากถึง 5,000 ตัวใน 5 นาทีในระยะที่ออกฤทธิ์) เนื่องมาจากการมีอยู่ของโปรตีนฟิวชัน (gp41) ไวรัสจึงกระตุ้นให้เกิดการสร้างโครงสร้างซินซิเชียลที่กว้างขวางอันเนื่องมาจากการรวมตัวของ T-helper ที่ติดเชื้อและไม่ติดเชื้อ ซึ่งส่งผลให้พวกมันตายเป็นจำนวนมาก โมเลกุลโปรตีน gpl20 ที่เกิดขึ้นในปริมาณมากจะหมุนเวียนในเลือดได้อย่างอิสระและจับกับตัวรับของ T-helper ที่ไม่ติดเชื้อ ส่งผลให้ T-killer จดจำและทำลายพวกมันได้เช่นกัน ไวรัสสามารถแพร่กระจายผ่านช่องทางระหว่างเซลล์จากเซลล์หนึ่งไปยังอีกเซลล์หนึ่ง ซึ่งในกรณีนี้ ไวรัสจะเข้าถึงแอนติบอดีได้ไม่ดี
เกณฑ์ทางคลินิกสำหรับการติดเชื้อ HIV
ในผู้ใหญ่ การติดเชื้อ HIV จะถูกวินิจฉัยเมื่อมีอาการร้ายแรงอย่างน้อย 2 อาการร่วมกับอาการเล็กน้อยอย่างน้อย 1 อาการ และไม่มีสาเหตุอื่นๆ ของภาวะภูมิคุ้มกันบกพร่องที่ทราบ (มะเร็ง ภาวะภูมิคุ้มกันบกพร่องแต่กำเนิด อดอาหารมาก เป็นต้น) อาการร้ายแรง ได้แก่:
- ลดน้ำหนักร้อยละ 10 ขึ้นไป;
- อาการไข้ที่มีมาเป็นเวลานาน เป็นๆ หายๆ หรือเป็นตลอด
- โรคท้องเสียเรื้อรัง
อาการเล็กน้อย: ไอเรื้อรัง ผิวหนังอักเสบทั่วไป งูสวัดเป็นซ้ำ เชื้อราในช่องปากและคอหอย เริมเรื้อรัง ต่อมน้ำเหลืองโตทั่วไป การวินิจฉัยโรคเอดส์ทำได้ในกรณีที่มีซาร์โคมาของคาโปซี เยื่อหุ้มสมองอักเสบจากเชื้อคริปโตค็อกคัส ปอดบวมจากเชื้อนิวโมซิสติสเท่านั้น ภาพทางคลินิกของโรคได้รับอิทธิพลจากการติดเชื้อฉวยโอกาสร่วมด้วย
วิธีการเพาะเชื้อไวรัสเอชไอวี (HIV)
HIV-1 และ HIV-2 สามารถเพาะเลี้ยงได้ในเซลล์ของลิมโฟไซต์ TCV4 - H9 เพียงโคลนเดียวที่ได้รับจากลิมโฟไซต์ TCV4 ของมะเร็งเม็ดเลือดขาว นอกจากนี้ ยังสามารถใช้เพาะเลี้ยงเซลล์แอสโตรไซต์แบบโมโนเลเยอร์ซึ่ง HIV-1 สามารถขยายพันธุ์ได้ดี เพื่อจุดประสงค์ดังกล่าวได้อีกด้วย ชิมแปนซีมีความอ่อนไหวต่อ HIV-1 ในสัตว์
ความต้านทานของไวรัสในสภาพแวดล้อมภายนอกต่ำ ไวรัสจะตายเมื่อได้รับแสงแดดและรังสี UV และจะถูกทำลายที่อุณหภูมิ 80 องศาเซลเซียสภายใน 30 นาที หากใช้สารฆ่าเชื้อทั่วไปภายใน 20-30 นาที เพื่อฆ่าเชื้อไวรัส จำเป็นต้องใช้สารฆ่าเชื้อไมโคแบคทีเรีย เนื่องจากมีประสิทธิภาพในการต่อต้านจุลินทรีย์ที่มีความต้านทานสูงที่สุด
การวินิจฉัยทางห้องปฏิบัติการของการติดเชื้อ HIV
วิธีหลักในการวินิจฉัยพาหะของไวรัสและการติดเชื้อ HIV คือการตรวจเอนไซม์อิมมูโนแอสเซย์ อย่างไรก็ตาม เนื่องจาก gpl20 มีโครงสร้างและแอนติเจนที่คล้ายคลึงกับตัวรับของเซลล์มนุษย์บางชนิด รวมถึงตัวรับที่ขนส่งอิมมูโนโกลบูลินผ่านเซลล์เยื่อบุผิวของเยื่อเมือก จึงอาจพบแอนติบอดีที่เกี่ยวข้องกับแอนติบอดีต่อ gpl20 ในร่างกาย ในกรณีนี้ อาจมีผล ELISA ที่เป็นบวกเท็จ ดังนั้น ซีรัมที่มีปฏิกิริยาบวกทั้งหมดของผู้ป่วยจะต้องผ่านการวิเคราะห์เพิ่มเติมโดยใช้วิธีอิมมูโนบล็อตหรือเวสเทิร์นบล็อต วิธีนี้ใช้การระบุแอนติบอดีที่อยู่ระหว่างการศึกษาหลังจากแยกด้วยอิเล็กโทรโฟเรซิสและการทดสอบในภายหลังโดยใช้แอนติบอดีต่อสปีชีส์ที่ติดฉลาก วิธีการทางไวรัสวิทยาไม่ค่อยได้ใช้เนื่องจากความซับซ้อนในการเพาะเลี้ยงไวรัส โคลนลิมโฟไซต์ H9 ใช้เพื่อรับแอนติเจนของไวรัส ซึ่งเป็นส่วนประกอบที่จำเป็นของระบบทดสอบการวินิจฉัย วิธีการ CPR ช่วยให้ตรวจจับไวรัสได้ในระยะเริ่มต้นของไวรัสในกระแสเลือด
การรักษาการติดเชื้อ HIV
จำเป็นต้องค้นหาหรือสังเคราะห์ยาที่มีประสิทธิภาพในการยับยั้งการทำงานของเอนไซม์ทรานสคริพเทสย้อนกลับ (revertase) หรือโปรตีเอสของไวรัส ยาเหล่านี้จะป้องกันการก่อตัวของโปรไวรัส DNA และ (หรือ) ยับยั้งการสืบพันธุ์ภายในเซลล์ของไวรัส กลยุทธ์สมัยใหม่ในการรักษาผู้ป่วยที่ติดเชื้อ HIV นั้นใช้หลักการของการใช้ยาร่วมกันที่ยับยั้งโปรตีเอสของไวรัส (หนึ่งในยา) และรีเวิร์สเอส (ยา 2 ชนิดที่แตกต่างกัน) - การบำบัดแบบผสมผสาน (สามชนิด) ในรัสเซีย ในการรักษาผู้ป่วยที่ติดเชื้อ HIV แนะนำให้ใช้ยาในประเทศ 2 ชนิดร่วมกัน ได้แก่ ฟอสฟาไซด์และคริซิแวน ซึ่งยับยั้งการสืบพันธุ์ของ HIV โดยเฉพาะในระยะเริ่มต้นและระยะท้ายของการสืบพันธุ์ โดยเฉพาะอย่างยิ่งเมื่อมีฤทธิ์ของอะซิโดไทมิดีนลดลง
ปัญหาของการป้องกันเฉพาะคือความจำเป็นในการสร้างวัคซีนที่จะรับประกันการสร้างภูมิคุ้มกันทางเซลล์ที่มีประสิทธิภาพโดยอาศัยลิมโฟไซต์ที่เป็นพิษต่อเซลล์ที่จำเพาะต่อไวรัสโดยไม่ต้องผลิตแอนติบอดีในปริมาณมาก ภูมิคุ้มกันดังกล่าวได้รับจากตัวช่วย Thl เป็นไปได้ว่าแอนติบอดี รวมถึงแอนติบอดีที่ทำลายไวรัส ไม่เพียงแต่ไม่มีประสิทธิภาพในการยับยั้งการติดเชื้อ HIV เท่านั้น แต่ยังยับยั้งภูมิคุ้มกันทางเซลล์ในระดับสูงอีกด้วย ดังนั้น วัคซีนป้องกัน HIV จะต้องตอบสนองความต้องการหลักสองประการก่อนเป็นอันดับแรก: ก) ปลอดภัยอย่างแน่นอน และ ข) กระตุ้นการทำงานของลิมโฟไซต์ที่เป็นพิษต่อเซลล์ T กำลังศึกษาประสิทธิภาพของวัคซีนรูปแบบต่างๆ ที่ได้จากไวรัสที่ถูกทำให้ตาย (ทำให้ไม่ทำงาน) และจากแอนติเจนแต่ละตัวที่มีคุณสมบัติในการป้องกันสูง แอนติเจนเหล่านี้สามารถแยกได้จากไวรัสเองหรือสังเคราะห์ขึ้นทางเคมี วัคซีนที่สร้างขึ้นโดยอาศัยวิธีการทางพันธุวิศวกรรมได้รับการเสนอขึ้นแล้ว วัคซีนนี้เป็นไวรัสวัคซิเนียรีคอมบิแนนต์ที่มียีน HIV ที่มีหน้าที่ในการสังเคราะห์แอนติเจนที่มีคุณสมบัติกระตุ้นภูมิคุ้มกันที่แข็งแกร่ง คำถามเกี่ยวกับประสิทธิภาพของวัคซีนเหล่านี้ต้องใช้เวลาค่อนข้างนานเนื่องจากระยะฟักตัวของการติดเชื้อ HIV ที่ยาวนานและเชื้อโรคมีความแปรปรวนสูง การสร้างวัคซีนที่มีประสิทธิภาพสูงสำหรับป้องกัน HIV ถือเป็นปัญหาพื้นฐานเร่งด่วน

